
טיפול ב Yescarta בקו שני בחולים עם לימפומה מפושטת של תאי B חוזרת או עמידה – תוצאות ממחקר עולם אמיתי בכנס 2024 ASH הוצגו נתוני עולם אמיתי של Yescarta כטיפול קו שני (2L) עבור לימפומה מפושטת של תאי B חוזרת או עמידה (R/R LBCL) בהתבסס על נתוני מחקרCIBMTR שכלל פרופיל חולים שלא נכללו במחקר ZUMA-7, בשל תחלואות נלוות או מחלות ממאירות קודמות. הקדמה: (Axicabtagene ciloleucel) Yescarta הוא טיפול המאושר בין השאר לחולים מעל גיל 18 הסובלים מלימפומה מפושטת של תאי B גדולים (DLBCL) ולימפומה של תאי B בדרגת ממאירות גבוהה (HGBL)אשר עמידה בפני, או נשנתה תוך 12 חודשים מסיום טיפול כימואימונותרפי בקו ראשון. וכמו כן, גם לחולים מעל גיל 18 שמחלתם נשנתה או עמידה הסובלים מלימפומה מפושטת של תאי B גדולים (DLBCL)לאחר שני קווי טיפול מערכתיים או יותר.
Yescarta הראתה פוטנציאל ריפוי בחולים בקו שלישי ואילך במסגרת מחקר הZuma 1 5 , כמו גם במטופלי קו שני, רפרקטוריים, או שמחלתם נשנתה עד שנה מקו הטיפול הראשון , במסגרת מחקר הפאזה שלישית, Zuma 7 6 במחקר הZuma 7 נצפה יתרון של Yescarta על פני הטיפול הסטנדרטי (טיפול סיסטמי כימותרפי במינון גבוה ולאחר מכן השתלה אוטולוגית) בחולים עם R/R LBCL המיועדים להשתלה, עם שיפור משמעותי של הישרדות ללא אירועים, שיעורי התגובה והישרדות כוללת. בפאזה שניה של מחקר נוסף, ה – ALYCANTE במסגרתו טופלו ב-Yescarta חולי R/R LBCL שלא היו מיועדים להשתלה, נצפו שיעורי תגובה גבוהים והפוגות ממושכות בחולים שאינם מתאימים להשתלה (Best ORR= 91.9% Best CR= 82.3) בפרקטיקה הקלינית ( Yescarta (Axi cel משמשת לטיפול בחולים עם מגוון רחב יותר של מאפיינים שלא תמיד הוכללו בניסויים קליניים, אך נתוני עולם האמיתי על טיפולי CAR-T בתור טיפול שני ל-R/R LBCL נותרו מוגבלים. ניתוח נתונים זה מציג נתונים מהעולם האמיתי על היעילות והבטיחות של Yescarta כטיפול קו שני עבור R/R LBCL במטופלים בארצות הברית.
תוצאות: הנתונים נאספו רטרוספקטיבית ממאגר ה-CIBMTR למחקר על חולים מבוגרים עם לימפומה מפושטת של תאי B חוזרת או עמידה .(R/R LBCL)
האוכלוסייה כללה 446 חולים עם DLBCL, HGBCL, FL דרגה 3B ו-PMBCL שטופלו ב-Yescarta כטיפול שני (2L) בין אפריל 2022 ליולי 2023 ב-89 מרכזים בארה”ב. הנתונים כללו גם חולים שפרופיל המטופל שלהם לא היה מתאים למחקר ה-Zuma -7 .
חציון זמן המעקב היה 12 חודשים לכל החולים; 11.8 חודשים לקבוצת המטופלים שהפרופיל שלהם לא נכלל ב ZUMA-7 (Ineligible), 12.1 חודשים לקבוצת המטופלים שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים (Eligible/ Unknown) ו- 10.3 חודשים לקבוצת ה-PMBCL. כמחצית מהמטופלים היו מוגדרים ככאלה שהפרופיל שלהם אינו מתאים ל- ZUMA 7 (Ineligible) בעיקר בגלל תחלואה נלווית (34%) ומחלות ממאירות קודמות (16%).
(ראה טבלה 1)
Adapted from Lee DC, et al. ASH 2024 (Abstract 526; oral)
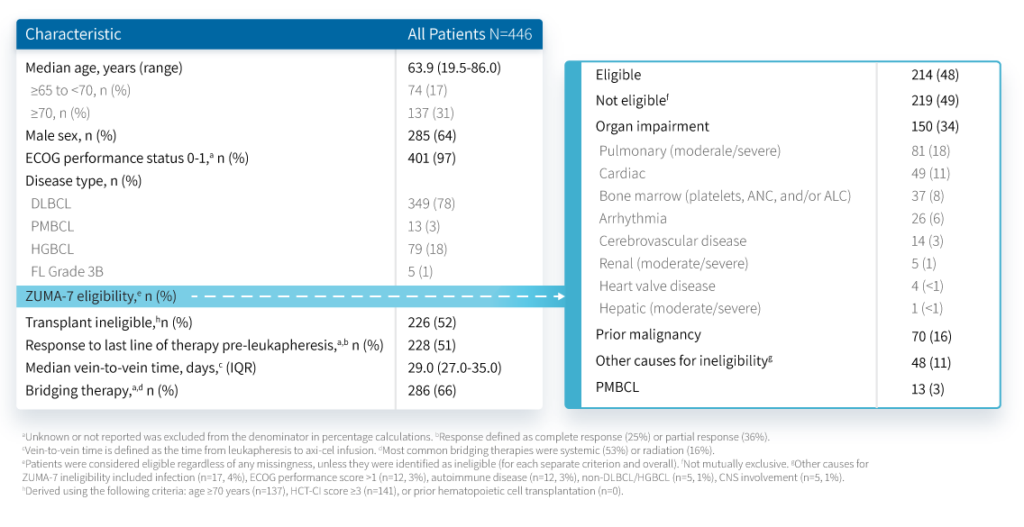
שיעורי התגובות האובייקטיביות (ORR) ותגובות מלאות (CR) היו עקביים בין כל קבוצות החולים. (איור 1) חציון הזמן לתגובה אובייקטיבית (median time to OR) היה 2.1 חודשים בסך הכל, עם 1.8 חודשים בקבוצת המטופלים שהפרופיל שלהם לא נכלל ב,ZUMA-7 2.4 חודשים בקבוצת המטופלים שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים, ו-3.0 חודשים בקבוצת הPMBCL- . באופן דומה, הזמן החציוני לתגובה מלאה (CR) היה 3.1 חודשים בסך הכל, 3.2 חודשים בקבוצת המטופלים שהפרופיל שלהם לא נכלל ב,ZUMA-7 3.1חודשים בקבוצת המטופלים שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים ו-3.0 חודשים בקבוצת הPMBCL.
איור 1
Adapted from Lee DC, et al. ASH 2024 (Abstract 526; oral)
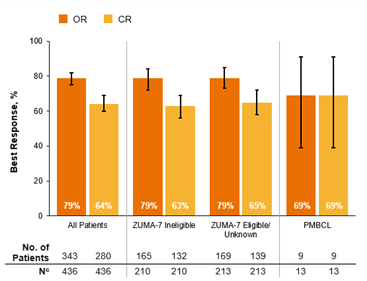
בקרב כל המטופלים עם חציון זמן מעקב של 12 חודשים, שיעור משך התגובה (DOR) ל-12 חודשים היה 66%. עבור קבוצת המטופלים שהפרופיל שלהם לא נכלל ב ZUMA-7 שיעור ה-DOR ל-12 חודשים היה 60%, בעוד שהוא היה 69% עבור אלו שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים. בקרב מטופלים עם PMBCL, שיעור ה-DOR ל-6 חודשים היה 100%. שיעור ההישרדות ללא אירועים (EFS) ל-12 חודשים היה 53% בכל המטופלים, עם שיעורים של 48% בקבוצת המטופלים שהפרופיל שלהם לא נכלל ב,ZUMA-7 ו-58% בקבוצת שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים. עבור מטופלים עם PMBCL, שיעור ה-EFS ל-6 חודשים היה 68%. שיעור ההישרדות הכוללת (OS) ל-12 חודשים היה 71% בכל המטופלים, עם שיעורים של 62% בקבוצת שהפרופיל שלהם לא נכלל ב ZUMA-7 ו-80% בקבוצת המטופלים שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים. עבור מטופלים עם PMBCL, שיעור ה-OS ל-6 חודשים היה 100% (איור 2).
איור 2
Adapted from Lee DC, et al. ASH 2024 (Abstract 526; oral)
שכיחות תסמונת שחרור ציטוקינים (CRS) בכל דרגה הייתה 87%, כאשר 5% חוו CRS בדרגה 3 ומעלה, באופן עקבי בין הקבוצות. אירועים נוירולוגיים (ICANS) בכל דרגה התרחשו ב-50% מהמטופלים, כאשר ICANS בדרגה 3 ומעלה דווח ב- 22%. הטיפולים הנפוצים כללו טוסיליזומאב (80%), קורטיקוסטרואידים (65%), אנטיאפילפטיים (19%) ואנאקינרה (18%) נויטרופניה ממושכת נצפתה ב-7%, תרומבוציטופניה ב-11% וזיהומים ב-44%. התמותה ארעה ב 25% מהחולים, 18% כתצואה מהתקדמות המחלה. כשיעור התמותה בקבוצת המטופלים שהפרופיל שלהם לא נכלל ב ZUMA-7 היה 32% ו- 18% בקבוצת המטופלים שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים.
מסקנות: זהו ניתוח הנתונים הגדול ביותר של נתוני עולם אמיתי של חולים עם לימפומה מפושטת של תאי B חוזרת או עמידה (R/R LBCL) שקיבלו אקסי-סל מסחרי כטיפול קו שני(2L) עם כ-52% מהחולים שלא היו כשירים למחקר ZUMA-7.
שיעור ההישרדות הכוללת (OS) ל-12 חודשים היה 71% בכל המטופלים, עם שיעורים של 62% בקבוצת המטופלים שהפרופיל שלהם לא נכלל ב ZUMA-7ו-80% בקבוצת המטופלים שהפרופיל שלהם כן נכלל ב/ZUMA-7 לא ידועים.
תוצאות היעילות והבטיחות במעקב חציוני של 12 חודשים נותרו עקביות עם אלו שדווחו במחקר ZUMA-7 למרות שכללו אוכלוסיית מטופלים רחבה יותר.
1. Lee DC, et al. ASH 2024 (Abstract 526; oral)
2. YESCARTA® (axicabtagene ciloleucel) Prescribing information. Kite Pharma, Inc; 2024
3. YESCARTA® (axicabtagene ciloleucel) [summary of product characteristics]. Amsterdam, The Netherlands: Kite Pharma
EU B.V.;2024
4. Westin JR, et al. N Engl J Med. 2023;389:148-157
5. Neelapu SS, et al. Blood. 2023;141:2307-2315
6. Locke FL, et al. N Engl J Med. 2022;386:640-654
7. Houot R, et al. Nat Med. 2023;29:2593-2601
8. https://cibmtr.org/
Yescarta
Yescarta is indicated for the treatment of adult patients with diffuse large B-cell lymphoma (DLBCL) and high-grade B-cell lymphoma
(HGBL) that relapses within 12 months from completion of, or is refractory to, first-line chemoimmunotherapy
Yescarta is indicated for the treatment of adult patients with relapsed or refractory (r/r) diffuse large B-cell lymphoma (DLBCL) and
primary mediastinal large B-cell lymphoma (PMBCL), after two or more lines of systemic therapy
Limitation of Use: Yescarta is not indicated for the treatment of patients with primary or secondary central nervous system
.lymphoma
Yescarta is indicated for the treatment of adult patients with relapsed or refractory follicular lymphoma (FL) after two or more lines of
.systemic therapy
.This content is intended for healthcare providers only
For further information and full list of adverse events, please refer to the approved prescribing information
as available at Israeli Ministry of Health website: https://israeldrugs.health.gov.il/#!/byDrug
Additionally, adverse events can be reported to Gilead: https://www.gileadisrael.co.il/utility/contact
For any further questions please contact: medinfo.israel@gilead.com
.© Gilead Sciences Israel Ltd. All rights reserved
IL-YES-0206, MAR 2024



